Stijging van Europese registraties
Het Zorginstituut voert 2 keer per jaar de Horizonscan Geneesmiddelen uit. Vergeleken met de Horizonscan van juni 2024 is te zien dat 81% meer indicatie-uitbreidingen van bestaande geneesmiddelen een positief advies van de European Medicines Agency (EMA) hebben gekregen. Een indicatie-uitbreiding betekent dat een medicijn al eerder voor een bepaalde aandoening is goedgekeurd voor de Europese markt en nu voor een nieuwe aandoening wordt beoordeeld. Daarnaast zijn er 61% meer nieuwe geneesmiddelen met een positief advies. Net als de vorige keer verwacht de Horizonscan van december 2024 de komende 2 jaar veel medicijnen en indicatie-uitbreidingen voor behandeling van kanker.
Horizonscan Geneesmiddelen: veel medicijnen tegen longkanker op komst
De Horizonscan Geneesmiddelen van Zorginstituut Nederland bekijkt voor de komende 2 jaar welke geneesmiddelen er verwacht worden op de Europese markt. Het gaat om 307 nieuwe geneesmiddelen en 230 bestaande geneesmiddelen voor een nieuwe aandoening. Er worden vooral veel nieuwe geneesmiddelen ontwikkeld voor longkanker.
Stijging van Europese registraties
Het Zorginstituut voert 2 keer per jaar de Horizonscan Geneesmiddelen uit. Vergeleken met de Horizonscan van juni 2024 is te zien dat 81% meer indicatie-uitbreidingen van bestaande geneesmiddelen een positief advies van de European Medicines Agency (EMA) hebben gekregen. Een indicatie-uitbreiding betekent dat een medicijn al eerder voor een bepaalde aandoening is goedgekeurd voor de Europese markt en nu voor een nieuwe aandoening wordt beoordeeld. Daarnaast zijn er 61% meer nieuwe geneesmiddelen met een positief advies. Net als de vorige keer verwacht de Horizonscan van december 2024 de komende 2 jaar veel medicijnen en indicatie-uitbreidingen voor behandeling van kanker.

Veel nieuwe medicijnen tegen longkanker
Longkanker is de aandoening met de meeste medicijnen op deze scan: in totaal 42. Ongeveer de helft daarvan zijn nieuwe geneesmiddelen en de andere helft indicatie-uitbreidingen. Het grootste deel van deze medicijnen zit in de laatste onderzoeksfase van de klinische studie. De patiënten die aan deze studie deelnemen krijgen of de bestaande behandeling of de nieuwe behandeling, de patiënten weten zelf niet welke behandeling ze krijgen. Zo is aan het einde van de studie duidelijk welke behandeling beter is.
Indicatiegebied longkanker
Als het gaat om kosten, laat de Horizonscan zien dat binnen de hoofdindicatie longkanker dure geneesmiddelen ontwikkeld worden voor zowel kleincellig longcarcinoom (SCLC) als niet kleincellig longcarcinoom (NSCLC). Voorbeelden hiervan zijn subcutane en orale geneesmiddelen voor de behandeling van NSCLC. Subcutaan betekent dat een medicijn onder de huid wordt toegediend en oraal betekent dat het via de mond wordt ingenomen. Omdat mogelijk een grote groep patiënten baat heeft bij deze geneesmiddelen, kan dit voor hoge kosten zorgen. Bij SCLC gaat het om kleinere groepen patiënten.
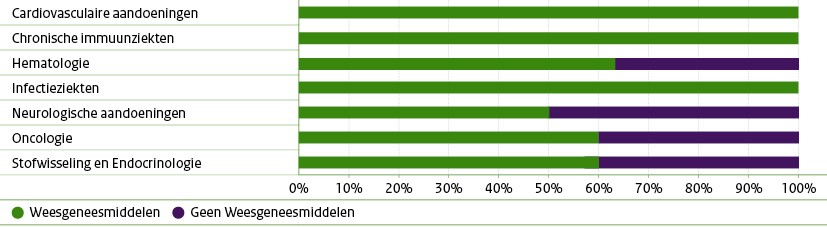
Dure medicijnen vooral bij ernstige en zeldzame aandoeningen
Op de nieuwe publicatie van de Horizonscan staan in de categorie dure geneesmiddelen ook 209 weesgeneesmiddelen en 41 cel- en gentherapieën (Advanced Therapy Medicinal Products, ATMP's). Dit zijn bijna allemaal geneesmiddelen voor de behandeling van ernstige, vaak zeldzame aandoeningen. Het gaat hier bijvoorbeeld om geneesmiddelen voor neurologische aandoeningen, hematologische ziektes en chronische immuunziekten.
Nieuw proces inbreng Medisch Specialisten
Afgelopen halfjaar is er ook een nieuw proces opgesteld waarmee de vroege signalen vanuit de Horizonscan werkgroepen bekrachtigt kunnen worden door de beroepsgroep. Daarbij wordt voor dure medicijnen nagegaan welke signalen de werkgroepen hebben afgegeven, Dit wordt voorgelegd aan geneesmiddelencommissies. Door middel van deze commissies wordt de inbreng van medisch specialisten beter en structureel verankerd in het beoordelingsproces van dure geneesmiddelen. Dit nieuwe proces is vastgelegd in een samenwerkingsafspraak tussen de Federatie Medisch Specialisten, Zorginstituut Nederland en Zorgverzekeraars Nederland (ZN). Meer informatie over dit nieuwe proces is te vinden op de website van de Federatie Medisch Specialisten.
Over Horizonscan Geneesmiddelen
De Horizonscan Geneesmiddelen is in 2017 gestart als een integraal, openbaar en zo objectief mogelijk overzicht van innovatieve geneesmiddelen die binnen nu en 2 jaar op de Europese markt worden verwacht. Ieder half jaar brengt het Zorginstituut in kaart wat de mogelijke impact is van nieuwe geneesmiddelen op de behandeling van patiënten en op de zorgkosten. Daarnaast is de Horizonscan Geneesmiddelen een monitor van indicatie-uitbreidingen van bestaande geneesmiddelen. Hierdoor zijn patiënten, behandelaars, ziekenhuizen, zorgverzekeraars en overheidsorganen vroegtijdig op de hoogte van ontwikkelingen van geneesmiddelen.
Meer informatie over de nieuwe Horizonscan Geneesmiddelen kunt u terugvinden in onderstaande factsheet.